نگاهی به اصول، عملکرد و کاربرد یک ابزار تحلیلی بنیادین
طیف سنجی جذب اتمی شعله (FAAS) روشی قدرتمند و تثبیت شده در شیمی تجزیه است که برای شناسایی و اندازه گیری کمی عناصر (عمدتا فلزات) در یک نمونه به کار می رود.
این تکنیک بر یک اصل ساده اما هوشمندانه استوار است: اتم های آزاد یک عنصر خاص، قادرند نور را در طول موج های بسیار مشخصی جذب کنند. میزان این جذب، مستقیما با تعداد اتم های آن عنصر در مسیر نور متناسب است، که این امکان را فراهم می کند تا غلظت عنصر مورد نظر در نمونه تعیین شود. FAAS به دلیل هزینه نسبتا پایین، سهولت استفاده و نتایج قابل اعتماد، به عنوان یک اسب کاری در بسیاری از آزمایشگاه های صنعتی، محیط زیستی، بالینی و تحقیقاتی شناخته می شود.
اصول بنیادی در پس پرده جذب اتمی
اساس کار FAAS بر دو پایه مهم استوار است:
جذب نور توسط اتم های آزاد: هر عنصر دارای یک ساختار الکترونی منحصربه فرد است. هنگامی که اتم های یک عنصر در حالت گازی و خنثی (اتم های آزاد در حالت پایه) قرار دارند، اگر نوری با طول موج دقیقا متناسب با اختلاف انرژی بین حالت پایه و یکی از حالت های برانگیخته الکترونی به آنها تابانده شود، الکترون های لایه بیرونی این اتم ها فوتون های نور را جذب کرده و به سطح انرژی بالاتر منتقل می شوند. این طول موج های جذبی برای هر عنصر کاملا اختصاصی است، مانند اثر انگشت.
قانون بیر-لامبرت (Beer-Lambert Law): این قانون بیان می کند که مقدار نوری که توسط یک ماده (در اینجا، بخار اتمی) جذب می شود، با غلظت اتم های جاذب نور و همچنین با طولی از مسیر که نور از درون نمونه عبور می کند، رابطه مستقیم (خطی) دارد. به زبان ساده تر، هرچه تعداد اتم های یک عنصر در مسیر نور بیشتر باشد، نور بیشتری در طول موج مشخصه آن عنصر جذب خواهد شد.
دستگاه FAAS میزان این جذب (Absorbance) را اندازه گیری می کند و با استفاده از منحنی کالیبراسیون، آن را به غلظت تبدیل می کند.
فرآیند حیاتی اتم سازی در شعله
برای اینکه جذب اتمی اتفاق بیفتد، نمونه (که معمولا به صورت محلول است) باید به گونه ای پردازش شود که عناصر موجود در آن به شکل اتم های آزاد، خنثی و در حالت گازی درآیند. این فرآیند “اتم سازی” نامیده می شود و در FAAS، این وظیفه بر عهده شعله است.
نمونه مایع ابتدا به ذرات بسیار ریز (آئروسل) تبدیل شده و سپس وارد یک شعله داغ می شود. در شعله، چندین مرحله اتفاق می افتد:
- حلال زدایی (Desolvation): حلال نمونه تبخیر می شود و ذرات جامد یا نمک خشک باقی می مانند.
- تبخیر (Vaporization): این ذرات جامد به بخار تبدیل می شوند.
- تفکیک (Dissociation): مولکول های موجود در بخار به اتم های منفرد و آزاد شکسته می شوند.
دمای شعله نقش حیاتی در کارایی این مراحل دارد. دما باید به اندازه ای بالا باشد که ترکیبات حاوی عنصر مورد نظر را به اتم های آزاد تجزیه کند، اما نه آنقدر زیاد که باعث یونیزاسیون قابل توجه اتم ها شود (زیرا یون ها نور را در طول موج های متفاوتی نسبت به اتم های خنثی جذب می کنند). رایج ترین ترکیب سوخت و اکسیدکننده برای شعله، هوا-استیلن (حدود ۲۳۰۰ درجه سانتی گراد) است که برای بسیاری از عناصر مناسب است. برای عناصری که ترکیبات پایدارتری در برابر حرارت تشکیل می دهند (مانند آلومینیوم، سیلیسیوم یا وانادیوم)، از شعله های داغ تری مانند نیتروس اکسید-استیلن (حدود ۲۹۰۰ درجه سانتی گراد) استفاده می شود.
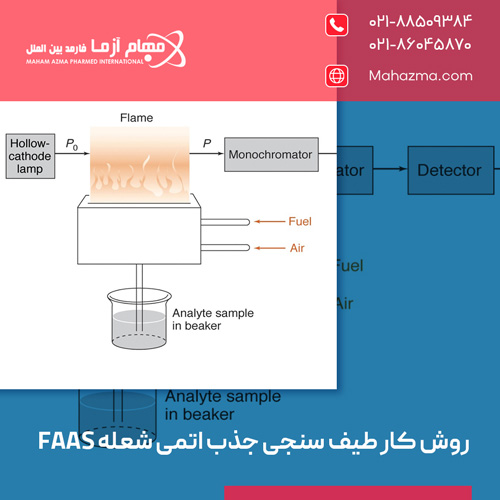
اجزای اصلی یک دستگاه FAAS
یک دستگاه طیف سنج جذب اتمی شعله از چندین بخش کلیدی تشکیل شده است:
-
منبع نور (Light Source)
منبع نور باید نوری با طول موج مشخصه عنصری که می خواهیم اندازه گیری کنیم، تولید کند. رایج ترین منبع نور در FAAS، لامپ کاتد توخالی (Hollow Cathode Lamp – HCL) است.
هر HCL برای یک عنصر خاص (یا گاهی چند عنصر با خطوط نشری نزدیک) ساخته می شود. این لامپ حاوی یک کاتد است که از عنصر مورد نظر (یا آلیاژی از آن) ساخته شده است. با اعمال ولتاژ، گاز پرکننده درون لامپ (مانند نئون یا آرگون) یونیزه شده و یون های گاز به سطح کاتد برخورد می کنند. این برخورد باعث کنده شدن اتم های عنصر کاتد و برانگیخته شدن آن ها می شود. در بازگشت به حالت پایه، این اتم ها نور مشخصه آن عنصر را نشر می کنند. استفاده از HCL اختصاصی برای هر عنصر، به گزینش پذیری بالای روش FAAS کمک شایانی می کند.
برای برخی عناصر که HCL آن ها شدت نور کافی تولید نمی کند (مانند آرسنیک و سلنیوم)، گاهی از لامپ های تخلیه بدون الکترود (Electrodeless Discharge Lamps – EDL) استفاده می شود که شدت نور بیشتری دارند.
-
سیستم معرفی نمونه و اتمساز شعله (Sample Introduction System and Flame Atomizer)
۱) مه پاش (Nebulizer)
محلول نمونه را به داخل مکیده و آن را به یک آئروسل ریز (مه) تبدیل می کند.
۲) محفظه اسپری (Spray Chamber)
این آئروسل با گاز سوخت و اکسیدکننده مخلوط می شود. قطرات بزرگتر آئروسل در این محفظه حذف شده و تنها ذرات ریز و یکنواخت به سمت شعله هدایت می شوند تا از نوسانات در شعله و کاهش کارایی اتم سازی جلوگیری شود.
۳) سرِ مشعل (Burner Head)
جایی است که گازهای سوخت، اکسیدکننده و آئروسل نمونه باهم می سوزند و شعله پایدار و طویلی را (معمولا به شکل یک شکاف باریک) ایجاد می کنند. پرتو نور از منبع، از طول این شعله عبور می کند.
۴) مونوکروماتور یا تک رنگ ساز (Monochromator)
پس از عبور نور از شعله (که بخشی از آن توسط اتم های نمونه جذب شده است)، نور وارد مونوکروماتور می شود. وظیفه مونوکروماتور، جداسازی طول موج تحلیلی موردنظر (که توسط HCL تولید و توسط نمونه جذب شده) از سایر طول موج های احتمالی (مانند نورهای دیگر تولید شده توسط HCL یا نورهای منتشر شده از خود شعله) است. این کار معمولا با استفاده از یک توری پراش (Diffraction Grating) انجام می شود که نور را بر اساس طول موج تفکیک می کند. تنها طول موج موردنظر از طریق یک شکاف خروجی باریک به سمت آشکارساز هدایت می شود.
۵) آشکارساز (Detector)
رایج ترین آشکارساز در FAAS، تیوب فتومالتی پلایر (Photomultiplier Tube – PMT) است. PMT یک آشکارساز بسیار حساس به نور است که فوتون های نور را به یک سیگنال الکتریکی قابل اندازه گیری تبدیل می کند. شدت این سیگنال الکتریکی متناسب با شدت نوری است که به آشکارساز رسیده است.
-
سیستم پردازش سیگنال و نمایش نتایج (Signal Processing and Readout System)
سیگنال الکتریکی از PMT تقویت شده و پردازش می شود. دستگاه، شدت نور اولیه (I₀، با عبور نور از نمونه شاهد یا بلانک) و شدت نور پس از عبور از نمونه (I) را اندازه گیری کرده و مقدار جذب (Absorbance, A) را طبق رابطه A = log(I₀/I) محاسبه می کند.
دستگاه های مدرن مجهز به کامپیوترهایی هستند که کنترل کامل دستگاه، جمع آوری داده ها، ایجاد منحنی کالیبراسیون از روی استانداردهای با غلظت مشخص، و محاسبه غلظت نمونه مجهول را انجام می دهند.
فرآیند گام به گام اندازه گیری در FAAS
- آماده سازی نمونه و استانداردها: نمونه ها باید به صورت محلول شفاف باشند. استانداردهایی با غلظت های مشخص از عنصر موردنظر نیز تهیه می شوند.
- روشن کردن دستگاه و تنظیمات: لامپ HCL مناسب نصب و روشن می شود، شعله تنظیم و پایدار می گردد و طول موج مناسب در مونوکروماتور انتخاب می شود.
- کالیبراسیون: ابتدا محلول بلانک (حلال خالص) و سپس محلول های استاندارد به ترتیب غلظت به دستگاه داده می شوند و میزان جذب برای هرکدام ثبت می گردد تا منحنی کالیبراسیون (جذب در برابر غلظت) رسم شود.
- اندازه گیری نمونه مجهول: محلول نمونه مجهول به دستگاه داده شده و میزان جذب آن خوانده می شود.
- محاسبه غلظت: با استفاده از منحنی کالیبراسیون، غلظت عنصر در نمونه مجهول تعیین می شود.
مزایا و قابلیت های دستگاه FAAS
-
هزینه نسبتا پایین و سادگی کاربری
دستگاه های FAAS معمولا ارزان تر از تکنیک های پیشرفته تری مانند ICP هستند و اپراتوری آن ها ساده تر است.
-
گزینش پذیری خوب
به دلیل استفاده از HCL های اختصاصی و خطوط جذبی باریک اتم ها، این روش از گزینش پذیری خوبی برخوردار است.
-
استحکام و قابلیت اطمینان
FAAS یک تکنیک جا افتاده و مقاوم است که برای بسیاری از عناصر نتایج قابل اعتمادی ارائه می دهد.
-
سرعت آنالیز (برای یک عنصر)
پس از کالیبراسیون، اندازه گیری هر نمونه برای یک عنصر خاص سریع است.
محدودیتها و معایب احتمالی
-
آنالیز تک عنصری
در هر بار تنظیم، تنها یک عنصر قابل اندازه گیری است. برای آنالیز چند عنصری، باید لامپ HCL و احتمالا شرایط دستگاه برای هر عنصر جداگانه تغییر کند که زمانبر است.
-
حساسیت محدودتر
در مقایسه با روش هایی مانند طیف سنجی جذب اتمی کوره گرافیتی (GFAAS) یا ICP-MS/OES، حساسیت FAAS برای بسیاری از عناصر کمتر است و معمولا در محدوده بخش در میلیون (ppm) قرار دارد.
-
مزاحمت ها
شیمیایی
تشکیل ترکیباتی در شعله که به راحتی به اتم های آزاد تجزیه نمی شوند (مثلا اثر فسفات بر کلسیم). با استفاده از عوامل آزادکننده یا شعله های داغ تر می توان بر این مزاحمت ها غلبه کرد.
یونیزاسیون
در شعله های داغ، بخشی از اتم ها ممکن است یونیزه شوند که باعث کاهش سیگنال جذب اتمی می شود. با افزودن یک سرکوب گر یونیزاسیون (ماده ای که به راحتی یونیزه می شود) این اثر کنترل می گردد.
طیفی
همپوشانی خطوط جذبی (نادر است) یا جذب یا پراکندگی نور توسط ذرات یا مولکول های دیگر در شعله (جذب پس زمینه). برای این منظور از روش های تصحیح پس زمینه (مانند لامپ دوتریوم یا اثر زیمان) استفاده می شود.
فیزیکی
تفاوت در خواص فیزیکی نمونه ها و استانداردها (مانند ویسکوزیته) که بر سرعت مکش و مه پاشی تأثیر می گذارد. با همسان سازی ماتریکس یا استفاده از استاندارد داخلی کنترل می شود.
عمدتا برای نمونه های مایع؛ نمونه های جامد نیاز به فرآیند انحلال دارند.
کاربردهای عمده FAAS
علی رغم ظهور تکنیک های جدیدتر، FAAS همچنان در بسیاری از حوزهها کاربرد دارد:
۱. شیمی بالینی
اندازه گیری الکترولیت ها مانند سدیم، پتاسیم، کلسیم و منیزیم و همچنین لیتیوم در مایعات بیولوژیکی
۲. صنایع غذایی و آشامیدنی
کنترل کیفیت و اندازه گیری فلزات کمیاب
۳. کشاورزی
آنالیز فلزات در خاک، کودها و محصولات گیاهی
۴. محیط زیست
پایش برخی فلزات در آب و پساب (هرچند برای آنالیزهای چند عنصری با حساسیت بالا، ICP ارجحیت دارد)
۵. صنعت
کنترل کیفیت مواد اولیه، محصولات آبکاری شده و آلیاژها
خلاصه و نتیجه گیری
طیف سنجی جذب اتمی شعله FAAS یک تکنیک تحلیلی ارزشمند و پرسابقه است که به دلیل ترکیب مناسبی از سادگی، هزینه کم، سرعت و قابلیت اطمینان برای آنالیز تک عنصری، همچنان جایگاه خود را در بسیاری از آزمایشگاه ها حفظ کرده است. اگرچه تکنیک هایی با حساسیت بالاتر یا قابلیت آنالیز چند عنصری سریع تر مانند ICP توسعه یافته اند، FAAS برای کاربردهای خاص و در شرایطی که محدودیت بودجه وجود دارد، یک انتخاب عالی و کارآمد باقی می ماند. درک صحیح اصول و محدودیت های آن برای بهره برداری بهینه از این ابزار کلاسیک ضروری است.
جهت اطلاع از موجودی کالاها و قیمت ها با مشاورین فروش شرکت تجهیزات آزمایشگاهی مهام آزما ۰۲۱۸۸۵۰۹۳۸۴ – ۰۲۱۸۶۰۴۵۸۷۰ در ارتباط باشید.





بدون نظر