PCR معمولی در برابر Real-time PCR (qPCR): بررسی جامع تفاوت ها، قابلیت ها و کاربردها
واکنش زنجیره ای پلیمراز (Polymerase Chain Reaction – PCR) انقلابی در دنیای زیست شناسی مولکولی ایجاد کرد و به دانشمندان این امکان را داد تا مقادیر بسیار ناچیز از یک قطعه DNA خاص را در مدت زمان کوتاهی به میلیون ها یا حتی میلیاردها نسخه تکثیر کنند. این تکنیک سنگ بنای بسیاری از پیشرفت ها در تحقیقات ژنتیکی، تشخیص بیماری ها، پزشکی قانونی و سایر حوزه های علوم زیستی بوده است. با گذر زمان و نیاز به اطلاعات دقیق تر و سریع تر، نسخه پیشرفته تری از این روش به نام Real-time PCR یا qPCR (Quantitative PCR) توسعه یافت که قابلیت های جدیدی، به ویژه در زمینه اندازه گیری کمی و پایش همزمان واکنش، به ارمغان آورد.
اما تفاوت دقیق این دو دستگاه و روش در چیست؟ چه زمانی باید از PCR معمولی و چه زمانی از Real-time PCR استفاده کرد؟ این توضیحات بر پایه اصول علمی تثبیت شده در کتاب های مرجع زیست شناسی مولکولی (مانند “ژنوم” اثر تی. ای. براون یا “اصول بیوشیمی لنینجر”) و راهنماهای تخصصی PCR و qPCR (ارائه شده توسط شرکت های پیشرو مانند Thermo Fisher Scientific, Bio-Rad, Qiagen) و مقالات علمی معتبر استوار است.
واکنش زنجیره ای پلیمراز (PCR) سنتی – سنگ بنای تکثیر DNA
PCR سنتی یا کلاسیک، یک روش آزمایشگاهی برای تکثیر هدفمند یک توالی مشخص از DNA است. هدف اصلی آن، تولید تعداد زیادی کپی از یک قطعه DNA کوچک است تا بتوان آن را برای آنالیزهای بعدی مانند مشاهده روی ژل، کلونینگ یا تعیین توالی، به مقدار کافی در اختیار داشت.
اجزای کلیدی واکنش PCR سنتی
DNA الگو (Template DNA)
نمونه DNA حاوی قطعه مورد نظر برای تکثیر
پرایمرها (Primers)
دو قطعه کوتاه DNA تکرشته ای (معمولا ۲۰-۳۰ نوکلئوتید) که به صورت اختصاصی به ابتدا و انتهای توالی هدف متصل می شوند و نقطه شروع همانندسازی را برای آنزیم پلیمراز مشخص می کنند.
آنزیم DNA پلیمراز (DNA Polymerase)
آنزیمی مقاوم به حرارت (مانند Taq polymerase که از باکتری Thermus aquaticus استخراج می شود) که نوکلئوتیدها را به انتهای پرایمرها اضافه کرده و رشته جدید DNA را سنتز می کند.
دئوکسی نوکلئوتید تری فسفات ها (dNTPs)
واحدهای سازنده DNA (A, T, C, G) که توسط آنزیم پلیمراز برای ساخت رشته های جدید استفاده می شوند.
بافر (Buffer)
محلولی که شرایط شیمیایی بهینه (مانند pH و غلظت یون منیزیم) را برای فعالیت آنزیم پلیمراز فراهم می کند.
مراحل چرخه حرارتی (Thermal Cycling) در PCR سنتی
واکنش PCR در دستگاهی به نام ترموسایکلر (Thermal Cycler) انجام می شود که دما را به سرعت و به طور متناوب در چرخه های تکراری تغییر می دهد. هر چرخه شامل سه مرحله اصلی است:
-
واسرشتگی (Denaturation)
دما به حدود ۹۴-۹۸ درجه سانتی گراد افزایش می یابد تا پیوندهای هیدروژنی بین دو رشته DNA الگو شکسته شده و دو رشته از هم جدا شوند.
-
اتصال پرایمر (Annealing)
دما به حدود ۵۰-۶۵ درجه سانتی گراد کاهش می یابد تا پرایمرها بتوانند به توالی های مکمل خود بر روی رشته های DNA الگو متصل شوند.
-
طویلسازی (Extension/Elongation)
دما به حدود ۷۲ درجه سانتی گراد (دمای بهینه برای فعالیت Taq پلیمراز) افزایش می یابد و آنزیم پلیمراز شروع به ساخت رشته جدید DNA از انتهای پرایمرها می کند.
این چرخه حرارتی ۲۰ تا ۴۰ بار تکرار می شود و در هر چرخه، تعداد نسخههای قطعه DNA هدف تقریبا دو برابر می شود، که منجربه تکثیر نمایی DNA می گردد.
محصول نهایی و روش آشکارسازی در PCR
پس از اتمام تمام چرخه ها، محصول PCR (که به آن آمپلیکون یا قطعه تکثیر شده نیز گفته می شود) به دست می آید. در PCR سنتی، تشخیص و آنالیز محصول معمولا پس از پایان واکنش (End-point detection) انجام می شود.
رایج ترین روش برای این کار، الکتروفورز روی ژل آگارز (Agarose Gel Electrophoresis) است. در این روش، محصولات PCR بر اساس اندازه خود روی ژل جدا شده و با استفاده از رنگ های متصل شونده به DNA (مانند اتیدیوم بروماید یا SYBR Safe) زیر نور UV قابل مشاهده می شوند. حضور یک باند با اندازه مورد انتظار، نشان دهنده موفقیت آمیز بودن تکثیر است. این روش عمدتا کیفی (تأیید حضور یا عدم حضور قطعه) یا در بهترین حالت نیمه کمی (تخمین تقریبی مقدار بر اساس شدت باند) است.
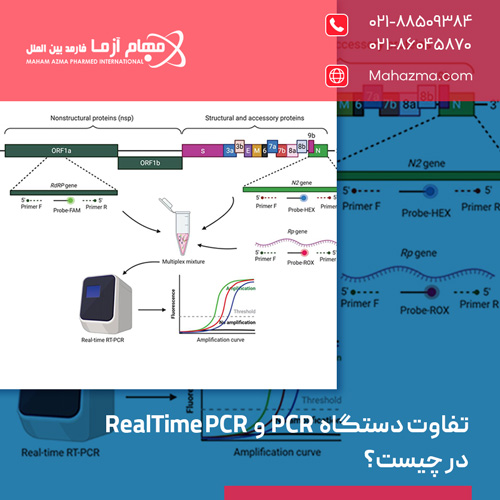
Real-time PCR (qPCR) نگاهی همزمان به تکثیر DNA
Real-time PCR یا qPCR، یک پیشرفت قابل توجه نسبت به PCR سنتی است. در حالی که اصول اولیه تکثیر DNA (اجزای واکنش و چرخه های حرارتی) مشابه PCR سنتی است، وجه تمایز اصلی qPCR، توانایی آن در پایش و اندازه گیری میزان تکثیر DNA به صورت همزمان با پیشرفت واکنش (Real-time) در هر چرخه است. این امر با استفاده از سیگنال های فلورسانس که با افزایش مقدار محصول PCR، افزایش می یابند، محقق می شود.
روش های آشکارسازی فلورسانس در qPCR
دو دسته اصلی از مواد شیمیایی فلورسانس در qPCR استفاده می شوند:
۱. رنگ های متصل شونده به DNA دو رشته ای (dsDNA-binding dyes)
SYBR Green I رایج ترین مثال از این دسته است. این رنگ هنگامی که به هر مولکول DNA دو رشته ای (dsDNA) متصل می شود، سیگنال فلورسانس قوی تولید می کند. با پیشرفت واکنش PCR و تولید بیشتر dsDNA، شدت فلورسانس افزایش می یابد.
مزیت: ارزان تر بودن و سادگی استفاده
عیب: عدم اختصاصیت؛ SYBR Green به هر نوع dsDNA، از جمله محصولات غیراختصاصی (Non-specific products) یا دایمرهای پرایمر (Primer-dimers)، متصل شده و سیگنال تولید می کند. برای بررسی اختصاصیت محصول، معمولا پس از اتمام qPCR، آنالیز منحنی ذوب (Melting Curve Analysis) انجام می شود که می تواند به تشخیص محصولات مختلف بر اساس دمای ذوب آن ها کمک کند.
۲. پروب های اختصاصی توالی (Sequence-Specific Probes)
این پروب ها قطعات کوتاه DNA تک رشته ای هستند که به طور اختصاصی به یک توالی خاص درون قطعه هدف (بین دو پرایمر) متصل می شوند و دارای یک یا چند مولکول گزارشگر فلورسانس (Reporter) و خاموش کننده (Quencher) هستند.
پروبهای TaqMan (Hydrolysis Probes): محبوب ترین نوع پروب هستند. این پروب ها در حالت دست نخورده، به دلیل نزدیکی گزارشگر و خاموش کننده، سیگنال فلورسانس کمی دارند. هنگامی که پروب به توالی هدف متصل می شود و آنزیم Taq پلیمراز (با فعالیت اگزونوکلئازی ‘۵ به ‘۳ خود) در حین طویل سازی به پروب می رسد، آن را تجزیه کرده و گزارشگر را از خاموش کننده جدا می کند. این جداسازی منجربه افزایش سیگنال فلورسانس می شود که مستقیما با مقدار محصول تکثیر شده متناسب است.
سایر انواع پروب: Molecular Beacons، FRET probes و Scorpion probes نیز از دیگر انواع پروب های اختصاصی هستند که هرکدام مکانیسم عملکرد خاص خود را دارند.
مزیت: اختصاصیت بسیار بالا، زیرا سیگنال فلورسانس تنها در صورت تکثیر توالی هدف صحیح تولید می شود. امکان انجام مالتی پلکس qPCR (تکثیر و شناسایی همزمان چند هدف مختلف در یک واکنش با استفاده از پروب هایی با رنگ های فلورسانس متفاوت) را فراهم می کنند.
عیب: گران تر بودن نسبت به SYBR Green و نیاز به طراحی و سنتز پروب اختصاصی برای هر هدف

دادههای خروجی و تحلیل در qPCR
دستگاه Real-time PCR مجهز به یک سیستم اپتیکی است که در هر چرخه، شدت فلورسانس را اندازه گیری می کند. خروجی معمول یک آزمایش qPCR شامل موارد زیر است:
-
نمودار تکثیر (Amplification Plot)
نموداری که شدت فلورسانس را برحسب شماره چرخه نشان می دهد. در ابتدا، سیگنال فلورسانس درحد پایه (Baseline) است. با افزایش محصول PCR، سیگنال از یک نقطه مشخص شروع به افزایش نمایی می کند.
-
آستانه (Threshold)
یک خط افقی که در فاز نمایی اولیه نمودار تکثیر، بالاتر از سیگنال پایه، توسط نرم افزار (یا کاربر) تعیین می شود.
-
چرخه آستانه (Ct – Cycle threshold) یا نقطه تقاطع (Cq – Quantification cycle)
شماره چرخه ای است که در آن، سیگنال فلورسانس نمونه از خط آستانه عبور می کند. مقدار Ct با مقدار اولیه DNA هدف در نمونه رابطه معکوس دارد؛ یعنی هرچه مقدار اولیه DNA هدف بیشتر باشد، سیگنال فلورسانس زودتر به آستانه می رسد و مقدار Ct کمتر خواهد بود. با استفاده از منحنی استاندارد (که با آنالیز نمونه هایی با غلظت مشخص از DNA هدف تهیه می شود)، می توان مقدار Ct نمونه مجهول را به مقدار کمی اولیه DNA تبدیل کرد.
مقایسه جامع PCR و Real-time PCR
حال به بررسی تفصیلی تفاوت های کلیدی بین PCR سنتی و Real-time PCR می پردازیم:
۱. آشکارسازی محصول
- اساسی ترین تفاوت در نحوه و زمان آشکارسازی محصول تکثیر شده نهفته است. در PCR سنتی، محصول نهایی تنها پس از اتمام کامل واکنش (End-point) قابل بررسی است، که معمولا با روش هایی مانند ژل الکتروفورز انجام می شود. این روش به ما می گوید آیا محصولی با اندازه مورد انتظار تولید شده است یا خیر
- در مقابل، Real-time PCR (qPCR) این امکان را فراهم می کند که تکثیر DNA به صورت همزمان با انجام واکنش و در هر چرخه با استفاده از سیگنال های فلورسانس پایش شود. این به معنای دیدن زنده فرآیند تکثیر است.
۲. کمیت سنجی (اندازه گیری مقدار)
- این تفاوت مستقیما از نحوه آشکارسازی ناشی می شود. PCR سنتی ذاتا یک روش کیفی است، یعنی بیشتر برای تشخیص حضور یا عدم حضور یک قطعه DNA خاص به کار می رود. هرچند با بررسی شدت باند روی ژل می توان تخمین نیمه کمی از مقدار محصول داشت، اما این روش دقت بالایی ندارد.
- (Real-time PCR (qPCR، همانطور که از نام دیگرش (PCR کمی) پیداست، به طور ویژه برای اندازه گیری دقیق مقدار اولیه DNA یا RNA هدف در نمونه طراحی شده است. با تحلیل داده های فلورسانس و مقدار Ct، می توان با دقت بالایی غلظت اولیه ماده ژنتیکی را تعیین کرد.
۳. سرعت و زمان کلی آنالیز
اگرچه زمان خود واکنش PCR در هر دو روش ممکن است مشابه باشد، Real-time PCR اغلب در مجموع سریع تر است. دلیل این امر آن است که در qPCR، داده های کمی به صورت همزمان با واکنش جمع آوری می شوند و نیاز به مراحل وقت گیر پس از واکنش مانند آماده سازی و اجرای ژل الکتروفورز، رنگ آمیزی و تصویربرداری برای کمی سازی از بین می رود یا به حداقل می رسد. در PCR سنتی، این مراحل پس از واکنش، زمان قابل توجهی به کل فرآیند اضافه می کنند.
۴. حساسیت و اختصاصیت
- Real-time PCR، به ویژه هنگامی که از پروب های اختصاصی توالی استفاده می شود، می تواند حساسیت و اختصاصیت بالاتری نسبت به PCR سنتی ارائه دهد. پایش همزمان و استفاده از پروب ها به کاهش احتمال تفسیر اشتباه محصولات غیراختصاصی به عنوان سیگنال مثبت کمک می کند.
- در PCR سنتی، اختصاصیت عمدتا به طراحی دقیق پرایمرها بستگی دارد و همواره احتمال ایجاد باندهای غیراختصاصی روی ژل وجود دارد که می تواند تفسیر نتایج را دشوار کند.
۵. خطر آلودگی محصول (Carryover Contamination)
- qPCR به دلیل ماهیت سیستم بسته (Closed-tube system) خود، خطر آلودگی محصول از یک واکنش به واکنش دیگر را به شدت کاهش می دهد. از آنجایی که آشکارسازی بدون نیاز به باز کردن تیوب های واکنش پس از اتمام PCR انجام می شود، احتمال انتشار آمپلیکون ها در محیط آزمایشگاه و آلوده کردن نمونه های بعدی بسیار کم است.
- در PCR سنتی، نیاز به باز کردن تیوب ها برای انتقال محصول به ژل الکتروفورز، این خطر آلودگی را افزایش می دهد.
۶. تجهیزات مورد نیاز
- برای انجام PCR سنتی، به یک ترموسایکلر معمولی نیاز است که تنها قابلیت تغییر برنامه ریزی شده دما را دارد.
- دستگاه Real-time PCR علاوه بر قابلیت یک ترموسایکلر برای اجرای چرخه های حرارتی، مجهزبه یک سیستم اپتیکی یکپارچه (شامل منبع نور برای تحریک فلورسانس، فیلترهای نوری و یک آشکارساز حساس برای اندازه گیری سیگنال فلورسانس) و همچنین نرم افزار تخصصی برای جمع آوری و تحلیل داده های فلورسانس است.
۷. هزینه ها
- هزینه خرید دستگاه PCR سنتی و همچنین هزینه مواد مصرفی اولیه برای هر واکنش در آن پایین تر است.
- دستگاه qPCR به دلیل تجهیزات اپتیکی و نرم افزار پیشرفته تر، هزینه خرید بالاتری دارد. همچنین، مواد مصرفی، به ویژه پروب های فلورسانس اختصاصی، می توانند هزینه هر واکنش را در qPCR افزایش دهند، هرچند استفاده از رنگ SYBR Green می تواند این هزینه را کاهش دهد.
۸. آنالیز پس از واکنش
- در PCR سنتی، انجام یک مرحله آنالیز پس از واکنش مانند ژل الکتروفورز تقریباً همیشه ضروری است تا بتوان محصول را مشاهده و تأیید کرد.
- در qPCR، برای اهداف کمی سازی، معمولا نیازی به آنالیز پس از واکنش نیست و داده های فلورسانس کافی هستند. با این حال، گاهی اوقات (به ویژه هنگام استفاده از SYBR Green) انجام آنالیز منحنی ذوب پس از اتمام واکنش برای بررسی اختصاصیت محصول و عدم وجود دایمر پرایمر مفید است.
۹. قابلیت مالتی پلکس (Multiplex Capability)
- qPCR، با استفاده از پروب هایی که با رنگ های فلورسانس مختلف نشان دار شده اند، امکان آنالیز همزمان چند هدف ژنی مختلف را در یک واکنش واحد (مالتی پلکس) به خوبی فراهم می کند.
- در PCR سنتی، انجام مالتی پلکس دشوارتر است و تشخیص محصولات مختلف روی ژل می تواند چالش برانگیز باشد، هرچند غیرممکن نیست.
۱۰. کاربردهای اصلی
- PCR سنتی همچنان برای کاربردهایی مانند کلونینگ قطعات DNA، آماده سازی نمونه برای تعیین توالی، ژنوتایپینگ های ساده (مانند تشخیص وجود یا عدم وجود یک آلل خاص) و تشخیص کیفی حضور پاتوژن ها بسیار مفید است.
- Real-time PCR (qPCR) به دلیل قابلیت کمی سازی دقیق، در حوزه های پیشرفته تری کاربرد دارد، از جمله: آنالیز بیان ژن (RT-qPCR برای اندازه گیری سطوح mRNA)، تعیین بار ویروسی (مثلا در بیماران مبتلا به HIV یا هپاتیت)، تشخیص و کمی سازی دقیق پاتوژن ها در نمونه های بالینی یا محیطی، ژنوتایپینگ SNP (پلی مورفیسم های تک نوکلئوتیدی)، تحقیقات سرطان، و کنترل ایمنی مواد غذایی
چه زمانی کدام روش را انتخاب کنیم؟
انتخاب بین PCR سنتی و Real-time PCR به هدف آزمایش، نوع اطلاعات مورد نیاز، بودجه و امکانات موجود بستگی دارد:
PCR سنتی را انتخاب کنید اگر:
- نیاز به تشخیص ساده حضور یا عدم حضور یک قطعه DNA دارید.
- محصول PCR برای کاربردهای بعدی مانند کلونینگ، خالص سازی یا تعیین توالی استفاده می شود.
- محدودیت شدید بودجه دارید و کمی سازی دقیق اولویت اصلی نیست.
- نیاز به بررسی اندازه دقیق محصول دارید. (که ژل الکتروفورز به خوبی این کار را انجام می دهد)
Real-time PCR (qPCR) را انتخاب کنید اگر:
- نیاز به اندازه گیری دقیق مقدار (کمیت سنجی) DNA یا RNA (پس از رونویسی معکوس به cDNA در روش RT-qPCR) دارید.
- حساسیت و اختصاصیت بالا برای تشخیص مقادیر کم هدف یا در نمونه های پیچیده ضروری است.
- نیاز به نتایج سریع و با توان عملیاتی بالا (High-throughput) دارید.
- کاهش خطر آلودگی محصول (Carryover contamination) بسیار مهم است.
کاربردهایی مانند آنالیز بیان ژن، تعیین بار ویروسی، تشخیص دقیق پاتوژن ها، مطالعات دارویی، یا تحقیقات ژنتیکی کمی مد نظر است.
نتیجه گیری مقاله: ابزارهایی مکمل با قابلیت های متمایز
هر دو تکنیک PCR سنتی و Real-time PCR ابزارهای فوق العاده ارزشمندی در زیست شناسی مولکولی هستند. PCR سنتی به عنوان یک روش بنیادی و مقرون به صرفه برای تکثیر و تشخیص کیفی DNA همچنان کاربردهای گسترده ای دارد. از سوی دیگر، Real-time PCR با فراهم آوردن امکان پایش همزمان واکنش، کمی سازی دقیق، حساسیت و اختصاصیت بالاتر و کاهش خطر آلودگی، قابلیت های جدید و وسیعی را به ویژه در حوزه های تحقیقاتی و تشخیصی پیشرفته ارائه داده است. درک صحیح از تفاوت ها، مزایا و محدودیت های هر یک، به پژوهشگران و متخصصان آزمایشگاهی کمک می کند تا ابزار مناسب را برای دستیابی به اهداف علمی و تشخیصی خود انتخاب نمایند.
جهت اطلاع از موجودی کالاها و قیمت ها با مشاورین فروش شرکت تجهیزات آزمایشگاهی مهام آزما ۰۲۱۸۸۵۰۹۳۸۴ – ۰۲۱۸۶۰۴۵۸۷۰ در ارتباط باشید.





بدون نظر